P.-S.
a) Tan solo tienes que aplicar la definición del porcentaje en masa que te da el enunciado y hacer los cambios de unidades oportunos:
![c = \frac{40\ \cancel{g}\ \ce{H2SO4}}{100\ \cancel{g\ D}}\cdot \frac{10^3\ mg}{1\ \cancel{g}}\cdot \frac{1.30\ \cancel{g\ D}}{1\ mL\ D} = \fbox{\color[RGB]{192,0,0}{\bm{520\ \frac{mg\ \ce{H2SO4}}{mL\ D}}}} c = \frac{40\ \cancel{g}\ \ce{H2SO4}}{100\ \cancel{g\ D}}\cdot \frac{10^3\ mg}{1\ \cancel{g}}\cdot \frac{1.30\ \cancel{g\ D}}{1\ mL\ D} = \fbox{\color[RGB]{192,0,0}{\bm{520\ \frac{mg\ \ce{H2SO4}}{mL\ D}}}}](local/cache-vignettes/L393xH42/2aa8a43940486ba1ac50c921d9e7f3ce-724d0.png?1733073168)
b) Ahora debes calcular los moles de soluto y expresar el volumen de la disolución en litros:
![M = \frac{40\ \cancel{g}\ \ce{H2SO4}}{100\ \cancel{g\ D}}\cdot \frac{1\ \text{mol}}{98\ \cancel{g}}}\cdot \frac{1.30\ \cancel{g\ D}}{1\ \cancel{mL}\ D}\cdot \frac{10^3\ \cancel{mL}}{1\ L} = \fbox{\color[RGB]{192,0,0}{\bm{5.30\ \frac{mol\ \ce{H2SO4}}{L\ D}}}} M = \frac{40\ \cancel{g}\ \ce{H2SO4}}{100\ \cancel{g\ D}}\cdot \frac{1\ \text{mol}}{98\ \cancel{g}}}\cdot \frac{1.30\ \cancel{g\ D}}{1\ \cancel{mL}\ D}\cdot \frac{10^3\ \cancel{mL}}{1\ L} = \fbox{\color[RGB]{192,0,0}{\bm{5.30\ \frac{mol\ \ce{H2SO4}}{L\ D}}}}](local/cache-vignettes/L471xH42/b8ca5244cb3d242e70357ef1e90beb95-bb96f.png?1733073168)
c) La normalidad la obtienes de manera muy rápida si tienes en cuenta el número de protones que tiene el ácido. La normalidad se define como los equivalentes de soluto por cada litro de disolución y esos equivalentes coinciden con el número de protones del ácido:
![N = \frac{5.30\ \cancel{mol}\ \ce{H2SO4}}{1\ L\ D}\cdot \frac{2\ eq}{1\ \cancel{mol}} = \fbox{\color[RGB]{192,0,0}{\bm{10.6\ \frac{eq\ \ce{H2SO4}}{L\ D}}}} N = \frac{5.30\ \cancel{mol}\ \ce{H2SO4}}{1\ L\ D}\cdot \frac{2\ eq}{1\ \cancel{mol}} = \fbox{\color[RGB]{192,0,0}{\bm{10.6\ \frac{eq\ \ce{H2SO4}}{L\ D}}}}](local/cache-vignettes/L343xH40/ddb94c4672518f54f01480415a47bb8f-e3ab6.png?1733073168)
d) La molalidad está definida en función de la
masa de disolvente , expresada en kilogramos. Si partes del dato del porcentaje en masa lo tienes más fácil:
![m = \frac{40\ \cancel{g}\ \ce{H2SO4}}{60\ \cancel{g}\ agua}\cdot \frac{1\ mol}{98\ \cancel{g}}\cdot \frac{10^3\ \cancel{g}}{1\ kg} = \fbox{\color[RGB]{192,0,0}{\bm{6.80\ \frac{mol\ \ce{H2SO4}}{kg\ agua}}}} m = \frac{40\ \cancel{g}\ \ce{H2SO4}}{60\ \cancel{g}\ agua}\cdot \frac{1\ mol}{98\ \cancel{g}}\cdot \frac{10^3\ \cancel{g}}{1\ kg} = \fbox{\color[RGB]{192,0,0}{\bm{6.80\ \frac{mol\ \ce{H2SO4}}{kg\ agua}}}}](local/cache-vignettes/L373xH42/96b52fa35c1a5f3e9c771d3c819b81db-c6b28.png?1733073168)
e) Para conocer la fracción molar del soluto es necesario saber los moles de cada sustancia. Debes calcular los moles de ácido y los moles de agua:
![40\ \cancel{g}\ \ce{H2SO4}\cdot \frac{1\ mol}{98\ \cancel{g}} = \color[RGB]{0,112,192}{\textbf{0.408\ mol\ \ce{H2SO4}} 40\ \cancel{g}\ \ce{H2SO4}\cdot \frac{1\ mol}{98\ \cancel{g}} = \color[RGB]{0,112,192}{\textbf{0.408\ mol\ \ce{H2SO4}}](local/cache-vignettes/L299xH41/5a9238ce6b590f68d9ce99785dfb2d21-93162.png?1733073168)
![60\ \cancel{g}\ \ce{H2O}\cdot \frac{1\ mol}{18\ \cancel{g}} = \color[RGB]{0,112,192}{\textbf{3.33\ mol\ \ce{H2O}} 60\ \cancel{g}\ \ce{H2O}\cdot \frac{1\ mol}{18\ \cancel{g}} = \color[RGB]{0,112,192}{\textbf{3.33\ mol\ \ce{H2O}}](local/cache-vignettes/L255xH41/fbcd3dce7cdc59550729f5d8d7e1232b-81c79.png?1733073168)
La fracción molar del ácido será:
![x_{\ce{H2SO4}} = \frac{n_{\ce{H2SO4}}}{n_T} = \frac{0.408\ \cancel{mol}}{(0.408 + 3.33)\ \cancel{mol}} = \fbox{\color[RGB]{192,0,0}{\bf 0.109}} x_{\ce{H2SO4}} = \frac{n_{\ce{H2SO4}}}{n_T} = \frac{0.408\ \cancel{mol}}{(0.408 + 3.33)\ \cancel{mol}} = \fbox{\color[RGB]{192,0,0}{\bf 0.109}}](local/cache-vignettes/L348xH42/56dfc2713b73fa5ede9607741dd5f3bd-bad0b.png?1733073168)
f) Si retomas el resultado obtenido en el apartado a) solo tienes que convertir la masa de soluto en
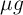
para tener una relación entre masa y volumen que sea de una parte por millón:
![ppm = \frac{520\ \cancel{mg}\ \ce{H2SO4}}{1\ mL\ D}\cdot \frac{10^3\ \mu\ g}{1\ \cancel{mg}} = \fbox{\color[RGB]{192,0,0}{\bm{5.2\cdot 10^5\ \frac{\mu g\ \ce{H2SO4}}{1\ mL\ D}}}} ppm = \frac{520\ \cancel{mg}\ \ce{H2SO4}}{1\ mL\ D}\cdot \frac{10^3\ \mu\ g}{1\ \cancel{mg}} = \fbox{\color[RGB]{192,0,0}{\bm{5.2\cdot 10^5\ \frac{\mu g\ \ce{H2SO4}}{1\ mL\ D}}}}](local/cache-vignettes/L394xH42/85a3482cb50a4c4178024cb12cb63853-8821c.png?1733073168)
Para calcular el volumen de disolución que necesitas para hacer la última disolución solo tienes que partir del dato calculado en el apartado c):
![V_i\cdot N_i = V_f\cdot N_f\ \to\ V_i = \frac{V_f\cdot N_i}{N_i} = \frac{500\ mL\cdot 0.2\ \cancel{N}}{10.6\ \cancel{N}} = \fbox{\color[RGB]{192,0,0}{\bf 9.43\ mL}} V_i\cdot N_i = V_f\cdot N_f\ \to\ V_i = \frac{V_f\cdot N_i}{N_i} = \frac{500\ mL\cdot 0.2\ \cancel{N}}{10.6\ \cancel{N}} = \fbox{\color[RGB]{192,0,0}{\bf 9.43\ mL}}](local/cache-vignettes/L468xH38/501292fae392a50857ed8af9b66f0a1b-34ebb.png?1733073168)
![]() del
del ![]() en peso tiene una densidad de 1.30 g/mL. Expresa la concentración de la misma en: a) mg/mL ; b) molaridad ; c) normalidad ; d) molalidad ; e) fracción molar y f) ppm. ¿Qué volumen de esta disolución será necesario para preparar 500 mL de otra disolución 0.2 N en ácido sulfúrico?
en peso tiene una densidad de 1.30 g/mL. Expresa la concentración de la misma en: a) mg/mL ; b) molaridad ; c) normalidad ; d) molalidad ; e) fracción molar y f) ppm. ¿Qué volumen de esta disolución será necesario para preparar 500 mL de otra disolución 0.2 N en ácido sulfúrico? Ejercicios FyQ
Ejercicios FyQ