Hibridación de átomos en una molécula (2986)
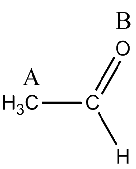
La hibridaciones del carbono A y del oxígeno B en la figura son, respectivamente:
a) A = ![]() y B =
y B = ![]()
b) A = ![]() y B =
y B = ![]()
c) A = ![]() y B =
y B = ![]()
d) A = ![]() y B =
y B = ![]()
La hibridaciones del carbono A y del oxígeno B en la figura son, respectivamente:

a) A = ![]() y B =
y B = ![]()
b) A = ![]() y B =
y B = ![]()
c) A = ![]() y B =
y B = ![]()
d) A = ![]() y B =
y B = ![]()