Porcentaje en masa inicial de una disolución que sufre una dilución
Un frasco contiene 330 mL de una solución de ácido nítrico cuya densidad es ![]() . Se le agrega agua hasta un volumen de
. Se le agrega agua hasta un volumen de ![]() , obteniéndose una solución cuya concentracion es 2 M. Calcula la concentración de la solucion inicial, expresada en
, obteniéndose una solución cuya concentracion es 2 M. Calcula la concentración de la solucion inicial, expresada en 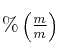 .
.
 Ejercicios FyQ
Ejercicios FyQ