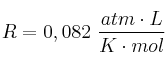PAU equilibrio químico 0014
El ![]() reacciona con el
reacciona con el ![]() a altas temperaturas según:
a altas temperaturas según:
![]()
Se introducen 4,4 g de
a) El número de moles de cada una de las especies en equilibrio.
b) El valor de las constantes ![]() y
y ![]() a esa temperatura.
a esa temperatura.
Datos: C = 12; O = 16; 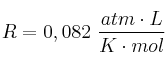
El ![]() reacciona con el
reacciona con el ![]() a altas temperaturas según:
a altas temperaturas según:
![]()
a) El número de moles de cada una de las especies en equilibrio.
b) El valor de las constantes ![]() y
y ![]() a esa temperatura.
a esa temperatura.
Datos: C = 12; O = 16;