Masa de ácido que se diluye hasta obtener una disolución de concentración y densidad conocidas
Se diluye una porción de una solución de ácido fosfórico (![]() ) al
) al 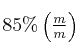 por agregado de agua hasta un volumen de
por agregado de agua hasta un volumen de ![]() . Se obtiene una solución al
. Se obtiene una solución al 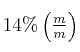 cuya densidad es
cuya densidad es ![]() . Calcula la masa de la porción del ácido utilizada.
. Calcula la masa de la porción del ácido utilizada.
 Ejercicios FyQ
Ejercicios FyQ