Energía libre de Gibbs y equilibrio químico 0001
Para la reacción de formación de agua, a 298 K y 1 atm, según la ecuación: 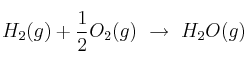 ;
; ![]() ;
; ![]() . Calcula:
. Calcula:
a) El valor de la variación de energía libre en estas condiciones.
b) La temperatura a la que el sistema no evoluciona por encontrarse en equilibrio, suponiendo que la entalpía y la entropía no varían con la temperatura.
 Ejercicios FyQ
Ejercicios FyQ