P.-S.
El 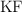 se disocia en agua dando lugar a las especies anión fluoruro
se disocia en agua dando lugar a las especies anión fluoruro 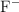 y catión sodio
y catión sodio 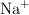 . El anión fluoruro podría modificar el equilibrio iónico del agua dado el valor de la constante de acidez del ácido correspondiente
. El anión fluoruro podría modificar el equilibrio iónico del agua dado el valor de la constante de acidez del ácido correspondiente 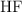 , aunque analizando este valor se puede intuir que la variación será mínima.
, aunque analizando este valor se puede intuir que la variación será mínima.
Debes escribir la reacción del fluoruro con el agua:
![\color[RGB]{2,112,20}{\textbf{\ce{F- + H2O <<=> HF + OH-}}} \color[RGB]{2,112,20}{\textbf{\ce{F- + H2O <<=> HF + OH-}}}](local/cache-vignettes/L212xH14/5766038ed4af835903162dc07e43e487-360c5.png?1623623116)
El fluoruro está actuando como base. Debes suponer que reaccionan
x moles de
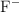
, por lo que la constante de basicidad de este equilibrio será:
![K_b = \frac{[\ce{HF}][\ce{OH-}]}{[F-}]} = \frac{x^2}{c_0 - } K_b = \frac{[\ce{HF}][\ce{OH-}]}{[F-}]} = \frac{x^2}{c_0 - }](local/cache-vignettes/L175xH42/40b276f649832d9eb6eaa197c163075d-1125f.png?1581660149)
El valor de
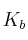
lo podemos obtener a partir del valor de
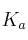
facilita el enunciado:
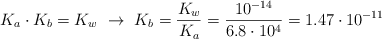
Despejas
x de la ecuación una vez que conoces el valor de
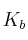
:
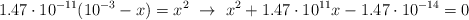
Si resuelves la ecuación de segundo grado obtienes como resultado
![\color[RGB]{0,112,192}{\bm{1.21\cdot 10^{-7}}} \color[RGB]{0,112,192}{\bm{1.21\cdot 10^{-7}}}](local/cache-vignettes/L81xH16/a2a2d2e14f6c3c30b426d06d84fa0b78-e3d56.png?1623623116)
. Este valor coincide con la concentración de
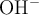
en la reacción y de ahí puedes calcular el pOH:
![pOH = -log\ [\ce{OH-}] = -log\ 1.21\cdot 10^{-7} = 6.92 pOH = -log\ [\ce{OH-}] = -log\ 1.21\cdot 10^{-7} = 6.92](local/cache-vignettes/L327xH20/04cd40c7584dc1811f3d5fd8aa43969e-21f5c.png?1581660149)
El pH lo obtienes a partir de la siguientes regla:
![pH + pOH = 14\ \to\ pH = 14 - 6.92 = \fbox{\color[RGB]{192,0,0}{\bf 7.08}}} pH + pOH = 14\ \to\ pH = 14 - 6.92 = \fbox{\color[RGB]{192,0,0}{\bf 7.08}}}](local/cache-vignettes/L330xH21/bbb8d129eba088d19bb9d790ccf0d8b6-e6ef4.png?1623623116)
Tal y como habías predicho, el pH apenas varía y queda casi neutro.
![]() .
.![]() .
.