Masa de hidrógeno recogida a partir de datos de P, T y V
El hidrógeno gaseoso (![]() ), se forma por la reacción de calcio metálico (Ca) con agua, siendo recolectado en un dispositivo de recolección en agua. El volumen de gas recolectado a
), se forma por la reacción de calcio metálico (Ca) con agua, siendo recolectado en un dispositivo de recolección en agua. El volumen de gas recolectado a ![]() y una presión de 988 mm Hg es de 641 mL. ¿Cuál es la masa en gramos del
y una presión de 988 mm Hg es de 641 mL. ¿Cuál es la masa en gramos del ![]() obtenido?
obtenido?
La presión de vapor del agua a ![]() es de 31,82 mm Hg. (
es de 31,82 mm Hg. (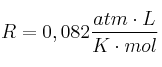 ; H = 1).
; H = 1).
 Ejercicios FyQ
Ejercicios FyQ