Energía necesaria para llevar hielo enfriado hasta vapor calentado
Halla la energía total necesaria para llevar un gramo de hielo desde ![]() hasta
hasta ![]() .
.
Datos: 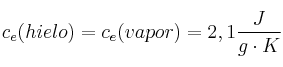 ;
; 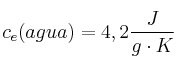 ;
; 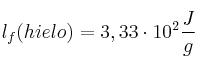 ;
; 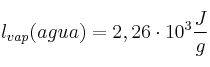 ;
; ![]() ;
; ![]()
Halla la energía total necesaria para llevar un gramo de hielo desde ![]() hasta
hasta ![]() .
.
Datos: 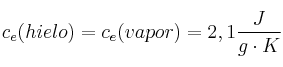 ;
; 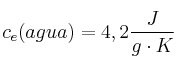 ;
; 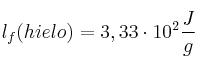 ;
; 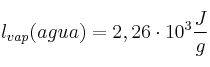 ;
; ![]() ;
; ![]()