P.-S.
Este problema se puede hacer de modo simple, si tenemos en cuenta el dato conocido del pH, o de modo más elaborado, si no tuviésemos el dato del pH. Vamos a plantear ambos modos de resolver para comprobar que el resultado es el mismo para estudiar el ejercicio en profundidad.
Si no tuviésemos el dato del pH.
La ecuación del proceso, con las concentraciones en el equilbrio en función del grado de disociación es:
![\color[RGB]{0,112,192}\bf{{\underset{c_0(1 - \alpha)}{\ce{HNO2}} \ce{+ H2O <=>} \underset{c_0\alpha}{\ce{NO2^-}} + \underset{c_0\alpha}{\ce{H3O^+}}}}}} \color[RGB]{0,112,192}\bf{{\underset{c_0(1 - \alpha)}{\ce{HNO2}} \ce{+ H2O <=>} \underset{c_0\alpha}{\ce{NO2^-}} + \underset{c_0\alpha}{\ce{H3O^+}}}}}}](local/cache-vignettes/L240xH30/a6d4a6ac5efcae5eb89ccaa937d9eca9-53e82.png?1733004475)
La concentración inicial del ácido la debes expresar en concentración molar porque así viene dada en la constante de acidez:
![c_0 = \frac{3.91\cdot 10^{-2}\ \cancel{g}}{100\ \cancel{mL}}\cdot \frac{1\ mol}{47\ \cancel{g}}\cdot \frac{10^3\ \cancel{mL}}{1\ L} = \color[RGB]{0,112,192}{\bm{8.32\cdot 10^{-3}\ M}} c_0 = \frac{3.91\cdot 10^{-2}\ \cancel{g}}{100\ \cancel{mL}}\cdot \frac{1\ mol}{47\ \cancel{g}}\cdot \frac{10^3\ \cancel{mL}}{1\ L} = \color[RGB]{0,112,192}{\bm{8.32\cdot 10^{-3}\ M}}](local/cache-vignettes/L380xH42/1b8d9bfbf7cd4133f280683b35280d82-1e418.png?1733004475)
A partir de la ecuación para la constante de acidez puedes obtener el valor del grado de disociación:

Sustituyes y obtienes una ecuación de segundo grado que debes resolver:

Obtienes dos valores pero solo uno tiene sentido químico:
![\color[RGB]{2,112,20}{\bm{\alpha = 0.219}} \color[RGB]{2,112,20}{\bm{\alpha = 0.219}}](local/cache-vignettes/L78xH12/bc2ea2b98c03f1c2fd5547221a9bb845-4898a.png?1733004475)
La concentración del ácido en el equilibrio será:
![[\ce{HNO2}] = 8.32\cdot 10^{-3}\ M\cdot (1 - 0.219) = \fbox{\color[RGB]{192,0,0}{\bm{6.50\cdot 10^{-4}\ M}}} [\ce{HNO2}] = 8.32\cdot 10^{-3}\ M\cdot (1 - 0.219) = \fbox{\color[RGB]{192,0,0}{\bm{6.50\cdot 10^{-4}\ M}}}](local/cache-vignettes/L399xH24/c96a0631e36490c83075b85d8c11efe8-8d2a8.png?1733004475)
Conocido el dato del pH.
Como la concentración del
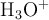
está escrita en función del grado de disociación, podrías calcularlo:
![pH = -log\ \ce{[H3O+}] = c_0\cdot \alpha\ \to\ \alpha = \frac{10^{-pH}}{c_0} = \frac{10^{-2.74}}{8.32\cdot 10^{-3}} = \color[RGB]{0,112,192}{\bf 0.219} pH = -log\ \ce{[H3O+}] = c_0\cdot \alpha\ \to\ \alpha = \frac{10^{-pH}}{c_0} = \frac{10^{-2.74}}{8.32\cdot 10^{-3}} = \color[RGB]{0,112,192}{\bf 0.219}](local/cache-vignettes/L470xH40/324934d6e376c61f2f6556f73d7891fa-a8721.png?1733004475)
Como el valor del grado de disoación es el mismo, la concentración será igual:
![[\ce{HNO2}] = 8.32\cdot 10^{-3}\ M\cdot (1 - 0.219) = \fbox{\color[RGB]{192,0,0}{\bm{6.50\cdot 10^{-4}\ M}}} [\ce{HNO2}] = 8.32\cdot 10^{-3}\ M\cdot (1 - 0.219) = \fbox{\color[RGB]{192,0,0}{\bm{6.50\cdot 10^{-4}\ M}}}](local/cache-vignettes/L399xH24/c96a0631e36490c83075b85d8c11efe8-8d2a8.png?1733004475)
![]() de
de ![]() y
y ![]() . Calcular la concentración de ácido nitroso en el equilibrio.
. Calcular la concentración de ácido nitroso en el equilibrio.![]() de
de ![]() y
y ![]() . Calcular la concentración de ácido nitroso en el equilibrio.
. Calcular la concentración de ácido nitroso en el equilibrio.